糖尿病引起的慢性伤口难以愈合,是导致患者生活质量下降甚至截肢的主要原因。其中,伤口局部血糖过高、多重耐药菌的持久感染以及持续的炎症反应相互交织,形成恶性循环。传统抗生素的效力因病菌耐药而下降,而现有的一些纳米酶疗法又缺乏可控性,可能导致过度产生活性氧,反而加重炎症、阻碍愈合。
西北工业大学黄维院士团队李鹏教授、张悦周副教授课题组开发了一种新型光控催化材料,能够智能调控糖尿病伤口微环境,有效解决高血糖、耐药菌感染和慢性炎症三大难题,改进糖尿病慢性伤口的治疗。
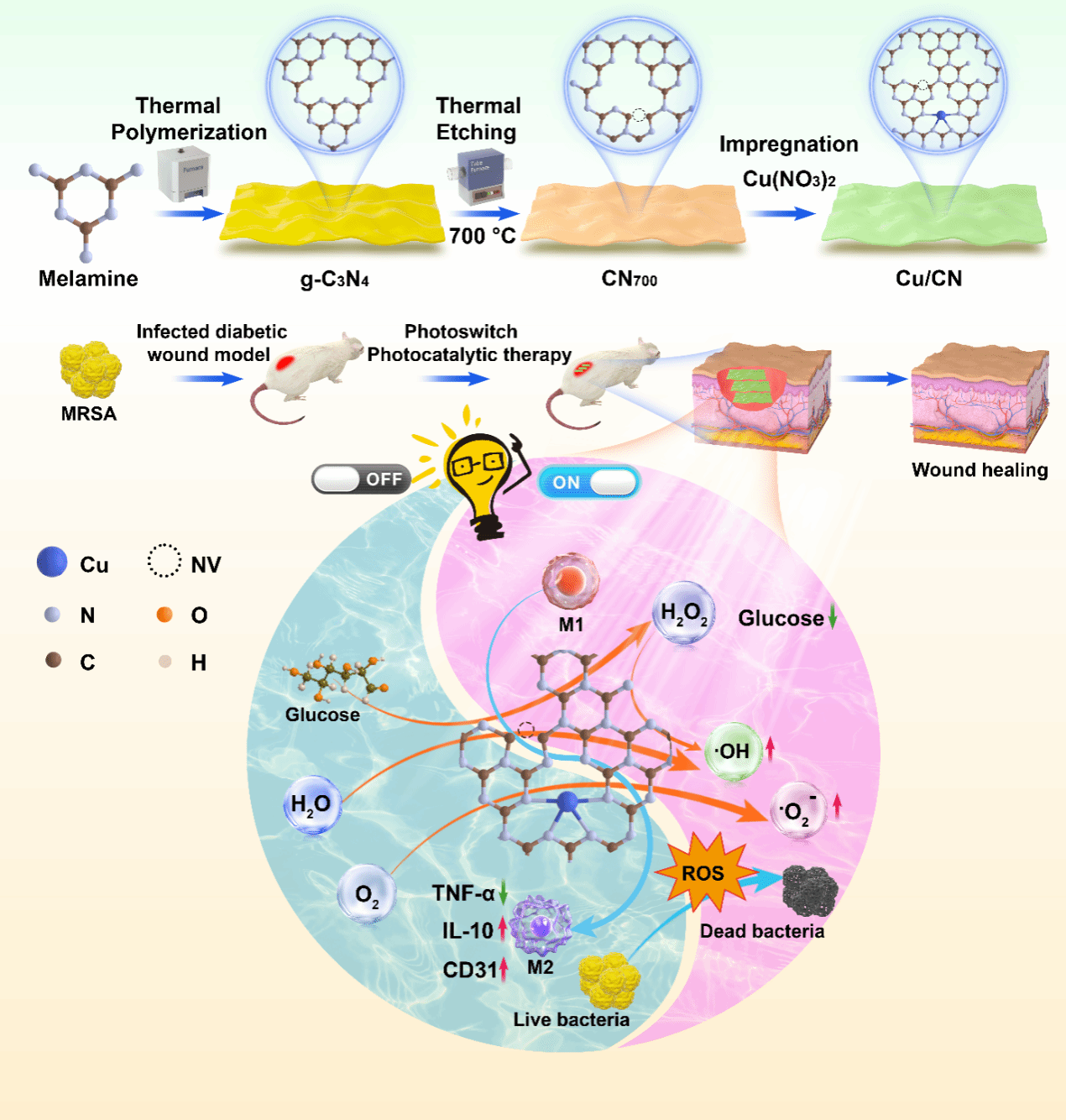
研究团队设计的这种名为Cu/CN的光催化剂,以石墨相氮化碳为基础,通过巧妙的“缺陷工程”(引入氮空位)和“单原子嵌入”(锚定铜单原子)协同优化而成,其最大特点是用可见光进行精准的“开关”控制。
· 光照下激活材料,启动“级联反应”开启治疗。
第一步降血糖:材料中的氮空位极大地增强了光催化氧化葡萄糖的能力,有效消耗伤口处过量的葡萄糖,切断细菌的“粮草”。
第二步强效杀菌:单原子铜催化上一步反应中产生的过氧化氢,将其转化为杀菌力更强的羟基自由基(•OH)和超氧阴离子(•O2–),对多重耐药菌的杀灭效率高达99.9%以上。
· 黑暗中停止催化,持续抗炎。
停止光照后材料催化反应显著减弱,不仅能避免过度产生活性氧,甚至能帮助清除伤口已有的过量活性氧,从而减轻氧化应激,缓解炎症,并促进M1型巨噬细胞向有助于组织修复的抗炎M2型转化。
动物实验表明,Cu/CN材料能够显著治疗糖尿病小鼠耐药菌感染伤口。经过该材料14天的治疗,糖尿病小鼠伤口部位MRSA耐药菌感染被显著抑制,伤口面积迅速缩小,上皮再生明显。与肝功能、肾功能相关的关键血液生化指标均在正常范围内,对心、肝、脾、肺、肾等重要器官的组织病理学切片观察显示,所有器官组织结构完整、细胞形态正常,未发现炎症、坏死或纤维化等病理性损伤,从器官水平证实了该材料良好的生物安全性。
本研究将氮空位与铜单原子协同策略用于构建光控智能催化材料,成功实现了对糖尿病伤口微环境的按需、精准、多功能的协同调控。这种非抗生素疗法避免了耐药性问题,且可控性高,大大降低了过度治疗的风险,为糖尿病慢性伤口的临床治疗提供了极具转化前景的新范式。
研究成果以“Cu Single-Atom Embedded g-C3N4 nanosheets Rehabilitate Multidrug-Resistant Bacteria Infected Diabetic Wounds via Photoswitchable Cascade Reaction”为题发表在Nature Communications上,西北工业大学柔性电子研究院在读博士研究生孙希臣和山西白求恩医院朱鹏琪副研究员为该论文的共同第一作者。
本研究获得国家自然科学基金、陕西省杰出青年学者科学基金和宁波重点研究项目资助。
文章链接:https://doi.org/10.1038/s41467-025-64242-z
(文字:张悦周 图片:张悦周 审核:李鹏)